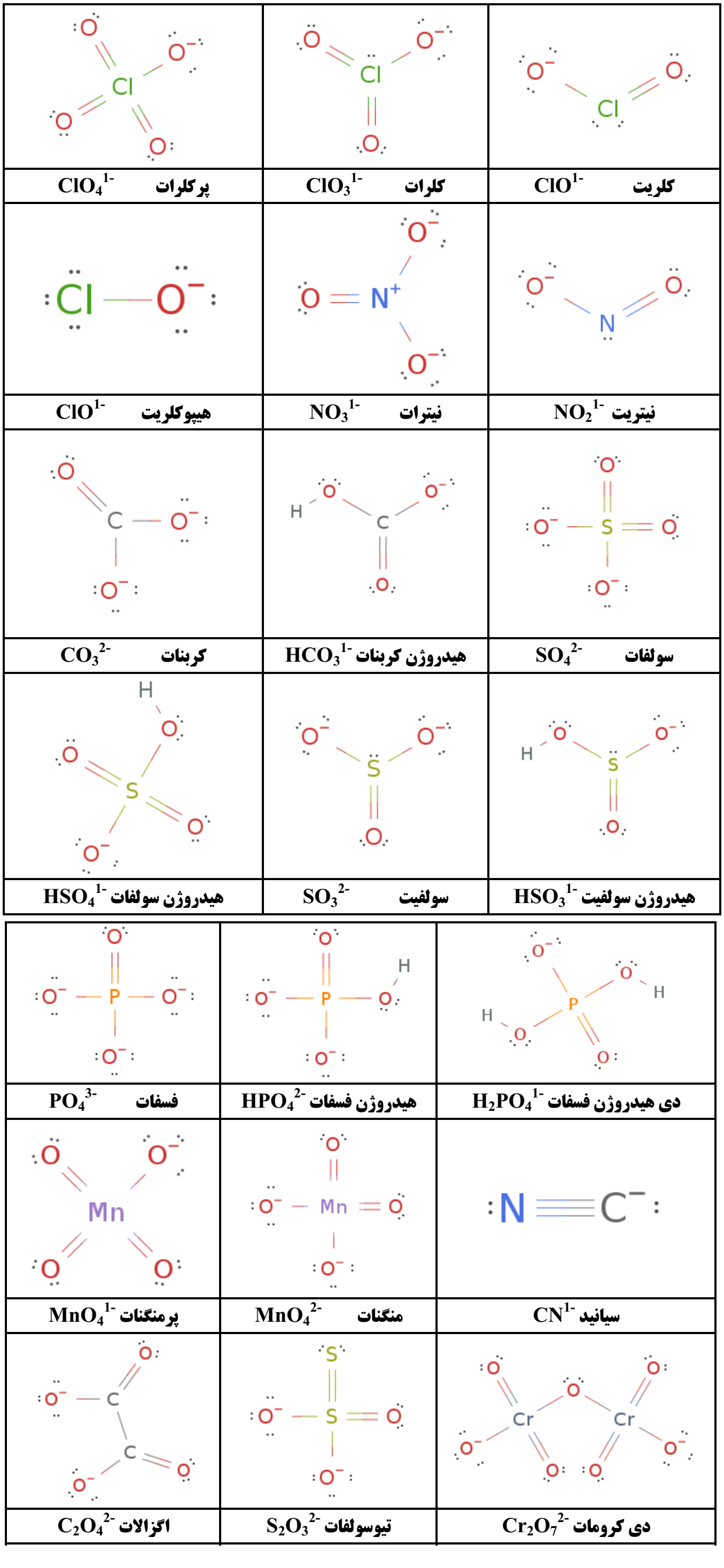
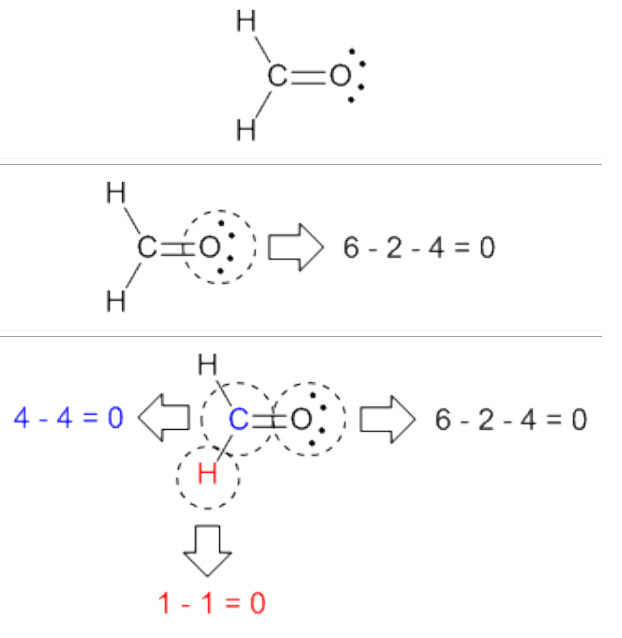
استوکیومتری واکنش : بخشی ازعلم شیمی است که به بررسی روابط کمی میان موادشرکت کننده دریک واکنش شیمیایی(معادله شیمیایی) می پردازد.
- پاسخ تمرین های دوره ای فصل دوم شیمی2یازدهم
- تمرین های تکمیلی قانون هس
- پاسخ تمرین های دوره ای فصل سوم شیمی دهم(شیمی1)
- نمونه سوال ظرفیت گرمایی
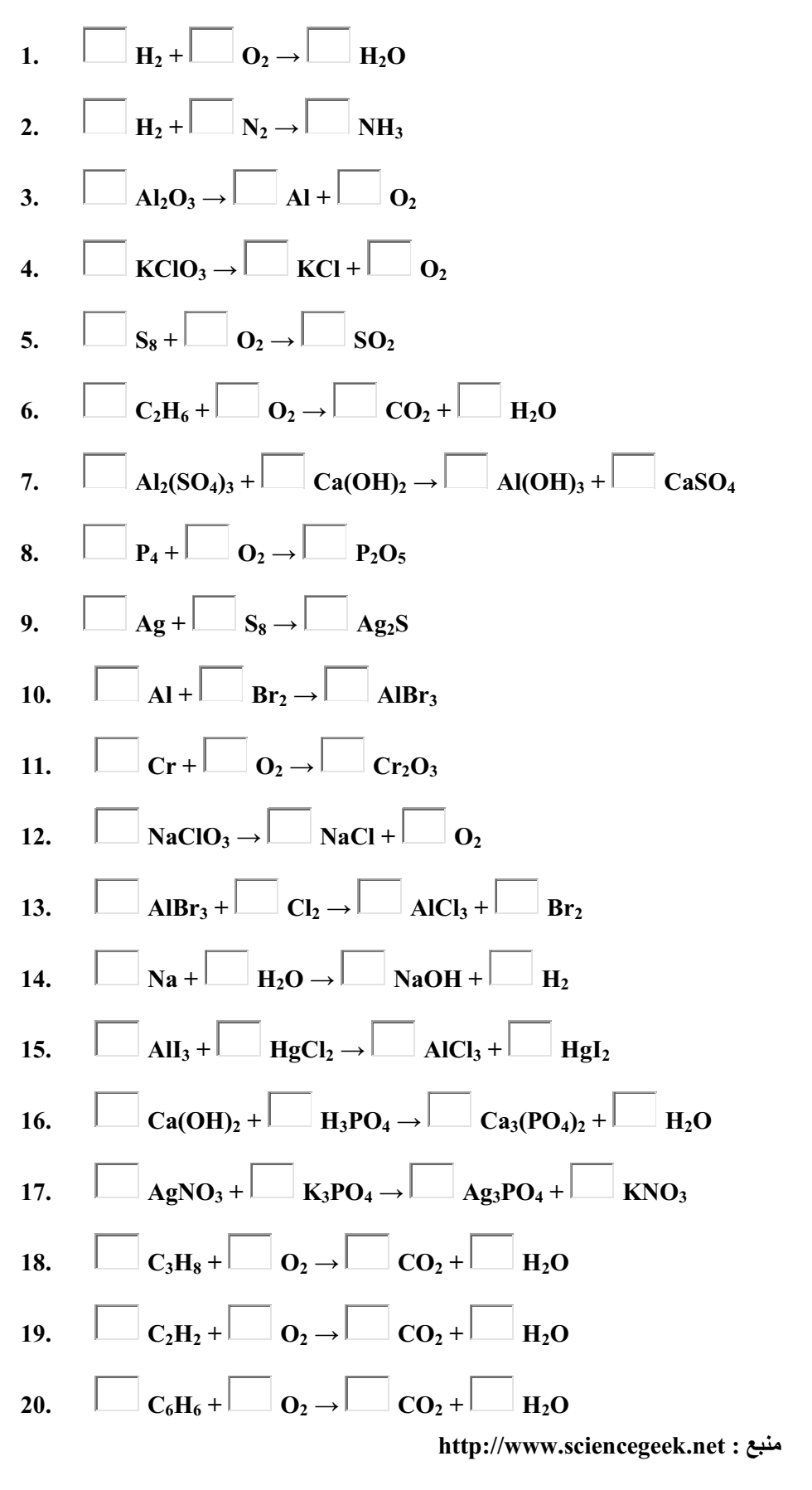
- موازنه ی چندمعادله ی شیمیایی
- سرعت واکنش
- استوکیومتری جرمی-حجمی
- عنوان اولین مطلب آزمایشی من
- گروه های عاملی
- پاسخ تمرین های دوره ای فصل اول شیمی دهم(شیمی1)
پربیننده ترین مطالب
- نمونه سوال4فصل اول شیمی دوازدهم
- نمونه سوال3فصل اول شیمی دوازدهم
- کلوپ بازی بروز(اندیشه)
- کلوپ بازی بروز
- آموزش خصوصی شیمی دوره دبیرستان
- نمونه سوال امتحان نهایی شیمی دوازدهم
- بارم بندی وبودجه بندی شیمی دوازدهم
- امتحان نهایی پایه دوازدهم
- نمونه سوال2فصل اول شیمی دوازدهم
- نمونه سوال1فصل اول شیمی دوازدهم